
百济神州公布2019年第四季度和全年财务业绩
百济神州(纳斯达克代码:BGNE;香港联交所代码:06160)是一家处于商业阶段的生物医药公司,专注于用于癌症治疗的创新型分子靶向和免疫肿瘤药物的开发和商业化。公司今天公布近期业务亮点、预计里程碑事件,以及2019年第四季度和全年财务业绩。
百济神州创始人、首席执行官兼董事长欧雷强先生表示:“自2010年和王晓东院士一起成立百济神州以来,我们已经走过了十个年头。最近我们公布了两项3期临床试验数据、BRUKINSA™(泽布替尼)和百泽安®在美国和中国分别获批、与安进公司建立的合作关系正式生效,为新的一年开了个好头。我们将就安进的三款商业阶段药物开展商业化发展,并对其20款候选药物进行临床开发。我们相信十周年的百济神州会持续2019的强劲发展势头,不断进步。未来的两年,我们预计将推进多至八款药物上市并继续推动临床开发,有望公布10多项3期或潜在的支持注册的临床试验结果。我们也继续推进公司早期药物管线,其中多款自主研发或授权引进药物即将进入临床开发阶段或公布概念验证数据。”
百济神州中国区总经理兼公司总裁吴晓滨博士表示:“尽管新冠病毒疫情对我们在中国的业务带来了一定的挑战,我们的团队继续推进公司的各项业务,为患者服务。疫情警报拉响之后,我们立刻采取了安全措施以保护在武汉和其他地区的员工,我们也很欣慰地报告所有百济神州的员工目前都安全。此外,百济神州是第一批采购安全防护设备的医药公司并将物资运抵疫情重灾区的各大医院。虽然我们预计此次疫情将对我们在中国的多项业务产生影响,我们仍然朝着百泽安®在今年第一季度商业化上市的目标努力。”
近期业务亮点
商业运营
- BRUKINSA™(泽布替尼)获得美国食品药品管理局(FDA)加速批准用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤(MCL)患者,并于获批一周之内商业上市
- 百泽安®(替雷利珠单抗注射液)获得国家药品监督管理局(NMPA)批准用于治疗至少经过二线系统化疗的经典型霍奇金淋巴瘤(cHL)患者,计划于本月实现商业化上市
- 截至2019年12月31日的年度产品收入为2.226亿美元 ,主要来自ABRAXANE®、瑞复美®和维达莎®在中国销售带来的收入,相比较2018年同期的产品收入,实现了70.1%的增加。截至2019年12月31日的第四季度收入为5689万美元。百济神州在新基物流有限责任公司(属于百时美施贵宝)的独家授权下,在华销售ABRAXANE®、瑞复美®和维达莎®
- 在中国递交了瑞复美®(来那度胺)联合利妥昔单抗用于治疗复发或难治性(R/R)惰性淋巴瘤(滤泡型淋巴瘤或边缘区淋巴瘤)患者的进口药品新适应症上市申请(sNDA),该sNDA已被受理被纳入优先审评
- ABRAXANE®被纳入国家医疗保障局药品集中采购名单,于2020年第二季度正式生效
临床项目
BRUKINSA™(泽布替尼),一款设计旨在最大化布鲁顿酪氨酸激酶(BTK)占有率、最小化脱靶效应的小分子抑制剂;在美国已获批
- 公布BRUKINSA™(泽布替尼)对比伊布替尼用于治疗华氏巨球蛋白血症(WM)患者的ASPEN 3期临床试验(clinicaltrials.gov登记号:NCT03053440)结果。尽管该试验的主要终点深度缓解(非常好的部分缓解[VGPR]或更好)未能达到有统计学意义的优效性,相比伊布替尼,泽布替尼取得了更高的VGPR率(28.4%,对比所有接受治疗患者中的19.2%)。同时泽布替尼在安全性和耐受性上对比伊布替尼也有显著改善。ASPEN是迄今为止在WM患者中开展的最大规模的3期临床试验,也是BTK抑制剂对比试验的首次数据公布
- 完成了用于治疗R/R边缘区淋巴瘤(MZL)患者的MAGNOLIA 2期临床试验(clinicaltrials.gov登记号:NCT03846427)的患者入组
- 在第61届美国血液学协会(ASH)年会上公布了以下数据:
- 在一项口头报告中首次公布了用于治疗缺失染色体17p的初治(TN)慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴癌(SLL)患者的SEQUOIA临床试验(clinicaltrials.gov登记号:NCT03336333)C组数据
- 在一项口头报告中公布了用于治疗CLL或SLL患者的1/2期临床试验(clinicaltrials.gov登记号:NCT02343120)的更新数据
- 在一项海报展示中公布了泽布替尼联合百泽安®用于治疗既往接受过治疗的B细胞恶性淋巴瘤患者的1b期临床试验(clinicaltrials.gov登记号:NCT02795182)的更新数据
- 在日本启动了泽布替尼用于治疗成熟B细胞恶性肿瘤患者的1/2期临床试验
泽布替尼预计里程碑事件
- 于2020年上半年在中国获批用于治疗R/R MCL患者以及R/R CLL或SLL患者
- 最早于2020年下半年公布泽布替尼对比苯达莫司汀联合利妥昔单抗用于治疗TN CLL或SLL患者的SEQUOIA临床试验的主要数据
- 于2020年在中国递交用于治疗WM患者的sNDA
- 与FDA和欧洲药品管理局(EMA)就ASPEN数据开展对话,并在2020年的一场主要医学会议上公布ASPEN 3期临床试验数据
- 于2020年完成泽布替尼对比伊布替尼用于治疗R/R CLL或SLL患者的ALPINE 3期临床试验扩展后的患者入组
百泽安®(替雷利珠单抗注射液),一款设计旨在避免与巨噬细胞中Fc受体结合、针对免疫检查点受体PD-1的人源化IgG4单克隆抗体
- 公布替雷利珠单抗联合化疗用于治疗一线鳞状非小细胞肺癌(NSCLC)患者的关键3期临床试验(clinicaltrials.gov登记号:NCT03594747)在预先计划的中期分析中,经独立评审委员会(IRC)评估,达到提高无进展生存期(PFS)这一试验主要终点。两组百泽安®试验组的安全性数据与各试验治疗已知的风险相符,未出现新的安全警示
- 获得了FDA授予的在肝细胞癌(HCC)和食管鳞状细胞癌(ESCC)两项适应症中的孤儿药物认定
- 在2019年欧洲肿瘤内科学会(ESMO)亚洲大会上公布了百泽安®联合化疗用于治疗用于治疗胃/胃食管结合部(G/GEJ)腺癌患者以及ESCC患者的2期临床试验(clinicaltrials.gov登记号:NCT03469557)的更新数据
百泽安®预计里程碑事件
- 于2020年在中国获批用于治疗局部晚期或转移性尿路上皮癌(UC)患者
- 于2020年在中国递交用于治疗一线鳞状NSCLC患者的sNDA
- 于2020年就百泽安®用于治疗二或三线HCC患者的全球2期临床试验(clinicaltrials.gov登记号:NCT03419897)的初步结果与药品监管机构进行沟通
- 于2020年公布在中国开展的百泽安®联合化疗对比化疗用于治疗一线非鳞状NSCLC患者的3期临床试验(clinicaltrials.gov登记号:NCT03663205)的主要数据
- 于2020年完成在中国开展的用于治疗错配修复缺陷(dMMR)或高微卫星不稳定(MSI-H)实体瘤患者的关键性2期临床试验(clinicaltrials.gov登记号:NCT03736889)的患者入组
- 于2020年初完成百泽安®对比多西他赛用于治疗二或三线NSCLC患者的3期临床试验(clinicaltrials.gov登记号:NCT03358875)全球部分的患者入组,以及百泽安®对比化疗用于治疗二线晚期ESCC患者的全球3期临床试验(clinicaltrials.gov登记号:NCT03430843)患者入组并于2020年或2021年初公布这两项试验的主要结果。
Pamiparib,一款在研高选择性PARP1和PARP2小分子抑制剂
- 宣布了将pamiparib对比安慰剂作为在以铂类药物为基础的一线化疗后产生缓解的不可手术的局部晚期或转移性胃癌患者维持治疗的临床试验(clinicaltrials.gov登记号:NCT03427814;或BGB-290-303)由3期转为2期的计划。公司还将对2期临床试验数据进行分析以评估pamiparib在这项适应中的潜力,以及作为单药疗法或与其他疗法结合的潜在开发计划。
Pamiparib预计里程碑事件
- 于2020年就在中国开展的用于治疗既往接受过治疗的三线或以上携带BRCA1/2突变的晚期卵巢癌(OC)患者的关键性2期临床试验(clinicaltrials.gov登记号:NCT03333915)的初步结果与药品监管机构进行沟通,并可能在中国递交针对该适应症的新药上市申请(NDA)
- 于2020年或2021年上半年公布pamiparib作为铂敏感复发性OC患者维持治疗的3期临床试验(clinicaltrials.gov登记号:NCT03519230)的主要结果
- 于2020年公布pamiparib联合百泽安®用于治疗晚期实体瘤患者的1期临床试验(clinicaltrials.gov登记号:NCT02660034)的更新结果
Sitravatinib,一款在研的酪氨酸激酶抑制剂,可有效抑制受体酪氨酸激酶(RTKs),其中包括 TAM 家族受体(TYRO3、Axl、MER)和 split 家族受体(VEGFR2、KIT)及 RET,由 Mirati Therapeutics 授权在亚洲(日本除外)、澳大利亚和新西兰的开发
- 在2019年12月举办的ESMO肿瘤免疫学会上的一项口头报告中公布了sitravatinib联合百泽安®用于治疗铂类耐药OC患者的1b期临床试验(clinicaltrials.gov登记号:NCT03666143)数据
Sitravatinib预计里程碑事件
- 于2020年在一场医学会议上公布sitravatinib联合百泽安®的1期临床试验数据
ZW25,一款在研Azymetric™双特异性抗体,与Zymeworks合作开展2期临床开发
ZW25预计里程碑事件
- 为计划中的针对复发性HER2阳性胆道癌(2020年)以及针对一线HER2阳性胃食管腺癌(2020年末和2021年初)的注册性试验的临床开发和患者入组提供支持
- 于2020年初启动一项1b/2期临床试验用于评估ZW25联合化疗和百泽安®对比ZW25联合化疗治疗晚期HER2阳性乳腺癌或G/GEJ腺癌患者
Lifirafenib,一款在研RAF二聚体抑制剂
Lifirafenib预计里程碑事件
- 于2020年在同行评议期刊上发表1期数据
BGB-A1217,一款在研TIGIT单克隆抗体
BGB-A1217预计里程碑事件
- 于2020年或2021年初公布1期临床试验
BGB-A445,一款在研非配位体抗OX40激动性单克隆抗体
- 启动了BGB-A445作为单药或联合百泽安®用于治疗晚期实体瘤患者的1期临床试验(clinicaltrials.gov登记号:NCT04215978)
BGB-3245,一款在临床前研究中展示了对抗单聚体和二聚体B-RAF突变型活性的在研B-RAF抑制剂,目前由百济神州和SpringWorks Therapeutics共同持有的MapKure进行开发
- 启动了用于治疗携带特定v-RAF鼠肉瘤病毒癌基因同源物B(B-RAF)基因突变型晚期或复发性患者的1期临床试验(clinicaltrials.gov登记号:NCT04249843)
BGB-11417,一款在研Bcl-2小分子抑制剂
- 在澳大利亚和美国启动了用于治疗成熟B细胞恶性肿瘤患者的1期临床试验的安排
BGB-11417预计里程碑事件
- 于2020年第一季度或第二季度初开展用于治疗成熟B细胞恶性肿瘤患者的1期临床试验患者入组
生产基地
- 广州生物药品生产基地于2019年12月获得药物生产许可证
- 启动了百泽安®生产程序验证
- 开启广州生物药品生产基地二期工程以扩大生产能力,预计于2020年底之前完成
公司发展
- 宣布了与安进公司达成的全球战略合作正式生效,将负责在中国商业化安加维 ®(XGEVA®)地舒单抗注射液、KYPROLIS®注射用卡非佐米和 BLINCYTO®注射用倍林妥莫双抗,并合作开发20款在研的安进抗肿瘤管线药物。安进购入了约28亿美元的百济神州美国存托股(ADS),约为公司20.5%的股份
- 宣布了与EUSA Pharma签署就其孤儿生物制剂药物SYLVANT®(司妥昔单抗)在大中华地区以及 QARZIBA®▼(dinutuximab beta)在中国大陆的独家开发和商业化协议
- 宣布了与Leap Therapeutics就其抗Dickkopf-1(DKK1)抗体DKN-01在亚洲(日本除外)、澳大利亚和新西兰的临床开发和商业化达成独家选择权和授权许可协议
新冠病毒疫情影响预期
- 公司预计,新冠病毒(COVID-19)疫情将对包括商业销售、药政沟通和检查,以及临床试验患者招募在内的中国业务带来一定的负面影响,取决于疫情的发展范围和持续时间,对公司的影响主要将在第一季度但也可能更久。公司正在努力减少疫情导致的工作延迟和中断,继续按照在中国制定的临床开发、药政事务以及商业化目标开展工作。
2019年第四季度和全年财务业绩
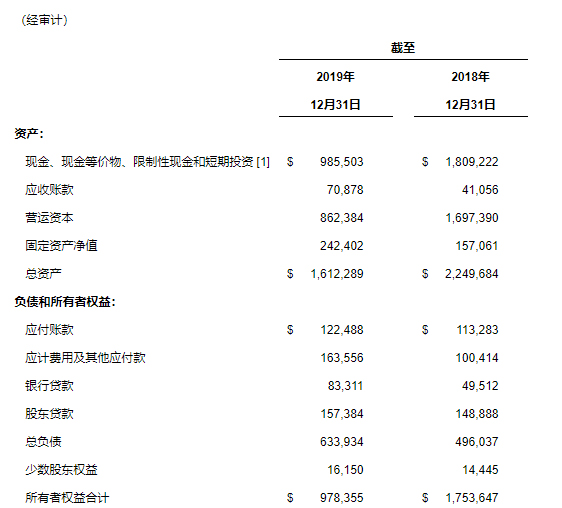
现金、现金等价物、受限资金和短期投资 截至2019年12月31日为9.855亿美元,相比较,2019年9月30日的持有额为12.8亿美元,2018年12月31日的持有额为18.1亿美元。截至2019年12月31日的现金和现金等价物不包括从2020年1月2日正式生效的安进合作协议中向其出售ADS所获得的28亿美元。
- 2019年第四季度的现金和短期投资总额减少了2.9109亿美元。经营活动所用现金为2.6718亿美元。资本支出为1546万美元,用于授权协议预付款的现金为2000万美元。
- 截至2019年12月31日的全年的现金和短期投资减少了8.2372亿美元。经营活动所用现金为7.5027亿美元。资本支出为8961万美元,用于授权协议预付款的现金为6900万美元。
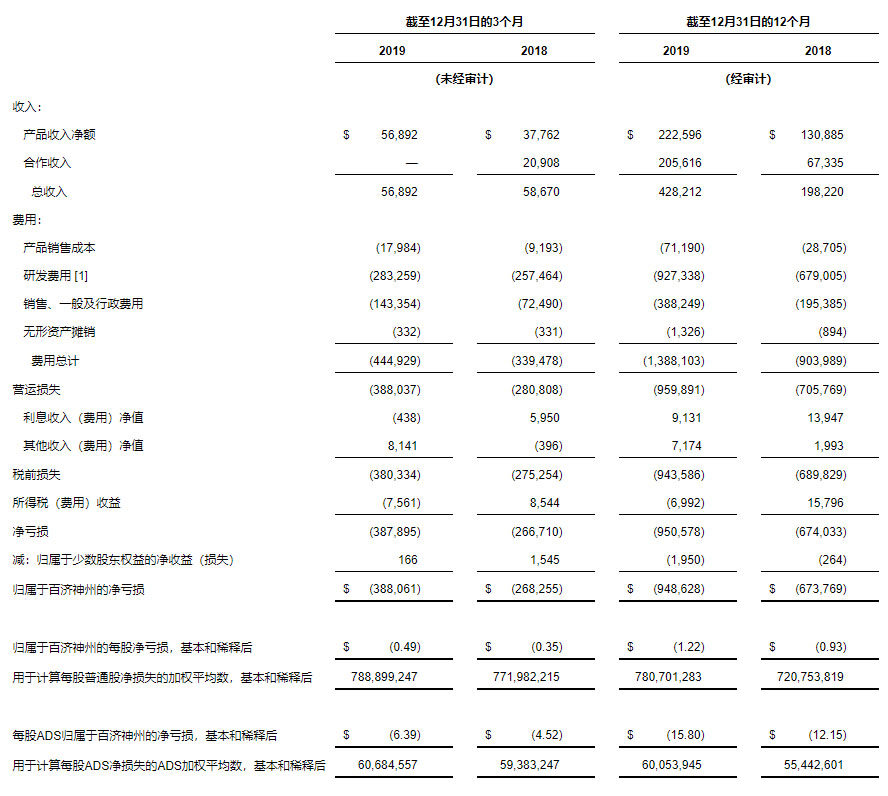
收入 截至2019年12月31日的第四季度和全年的收入分别为5689万美元和4.2821亿美元,相比较,2018年同期收入分别为5867万美元和1.9822亿美元。季度同比略有减少主要归因于与新基公司关于百泽安®合作协议终止后缺少合作收入,其中部分与ABRAXANE®、瑞复美®和维达莎®在华的产品收入以及BRUKINSA™(泽布替尼)在美的产品收入的增加相抵消。年度同比增加主要归因于与新基公司(属于百时美施贵宝)就终止百泽安®合作协议获得的1.5亿美元,以及产品收入的增加。
- 截至2019年12月31日的第四季度和全年的产品收入分别为5689万美元和2.226亿美元,相比较,2018年同期产品收入分别为3776万美元和1.3089亿美元。
- 截至2019年12月31日的第四季度和全年的合作收入分别为零和2.0562亿美元,相比较,2018年同期的合作收入分别为2091万美元和6743万美元。2019年全年收入包括与新基公司就终止百泽安®合作所获得的1.5亿美元。
费用 截至2019年12月31日的第四季度和全年的费用分别为4.4493亿美元和13.9亿美元,相比较,2018年同期的费用分别为3.3948亿美元和9.0399亿美元。
- 销售成本 截至2019年12月31日的第四季度和全年的销售成本分别为1798万美元和7119万美元,相比较,2018年同期的销售成本分别为919万美元和2871万美元。销售成本与收购ABRAXANE®、瑞复美®和维达莎®用于中国分销有关。
- 研发(R&D)成本 截至2019年12月31日的第四季度和全年的研发成本分别为2.8326亿美元和9.2734亿美元,相比较,2018年同期的研发成本分别为2.5746亿美元和6.7901亿美元。研发成本的增加主要归因于泽布替尼和百泽安®关键性临床试验持续进行的患者入组和扩展,后期候选药物的注册登记,商业化前生产和供应,以及临床前项目的扩展。研发费用的总体增加还归因于员工股权奖励支出的增加,截至2019年12月31日的第四季度和全年的股权奖励支出分别为2169万美元和7629万美元,相比较,2018年同期的股权奖励支出分别为1609万美元和5438万美元。该增加主要由于员工人数增加和股票价格的上涨。
- 销售、一般及行政管理(SG&A)费用 截至2019年12月31日的第四季度和全年的销售、一般及行政管理费用分别为1.4335亿美元和3.8825亿美元,相比较,2018年同期的销售、一般及行政管理费用分别为7249万美元和1.9539亿美元。销售、一般及行政管理费用的增加主要归因于员工人数的增加,包括扩大商业团队规模以支持在华和在美上市产品的分销,日益增多的商业活动以及提高的专业服务费和运营活动发展所需成本的增加。销售、一般及行政管理费用的总体增加还由于与此相关的股票期权费用的增加。截至2019年12月31日的第四季度和全年的股票期权费用分别为1665万美元和5786万美元,相比较,2018年同期的股票期权费用分别为987万美元和3274万美元。该增加主要由于员工人数增加和股票价格的上涨。
- 净亏损 截至2019年12月31日的第四季度和全年的净亏损分别为3.8806亿美元和9.4863亿美元,或每股0.49美元和1.22美元,或每股ADS 6.39美元和15.8美元;相比较,2018年同期的净亏损分别为2.6826亿美元和6.7377亿美元,或每股0.35美元和0.93美元,或每股ADS 4.52美元和12.15美元。
财务摘要
简要合并资产负债表摘要数据(美国一般公认会计准则)
(单位为1,000美元)
简要合并营运报表(美国一般公认会计准则)
(除普通股数量、ADS 数量、每股普通股和每股ADS 数据外,单位为1,000 美元)
关于百济神州
百济神州是一家全球性的、商业阶段的、以研发为基础的生物科技公司,专注于分子靶向和免疫肿瘤疗法的研发。百济神州目前在中国大陆、美国、澳大利亚和欧洲拥有3500 多名员工,在研产品线包括新型口服小分子类和单克隆抗体类抗癌药物。百济神州目前也正在打造抗癌治疗的药物组合方案,旨在为癌症患者的生活带来持续、深远的影响。百济神州在美国销售其自主研发的BTK 抑制剂BRUKINSA™(泽布替尼);在中国,其抗PD1 抗体药物百泽安®(替雷利珠单抗)已经获得上市批准。在新基物流有限责任公司(属于百时美施贵宝公司)的授权下,百济神州在华销售ABRAXANE®注射用紫杉醇(白蛋白结合型)、瑞复美®(来那度胺)和维达莎®(注射用阿扎胞苷)[i];在安进公司的授权下,百济神州计划在华销售安加维®(XGEVA®)地舒单抗注射液[ii]。
前瞻性声明
本新闻稿包含根据《1995 年私人证券诉讼改革法案》(Private Securities Litigation Reform Act of 1995)以及其他联邦证券法律中定义的前瞻性声明。包括有关百济神州候选药物令人鼓舞的临床数据、本公司药物产品收入、后期临床试验和预计数据公布、本公司药物候选物的预计的商业发布、预期的临床开发计划、药政注册里程碑和商业化进程、新冠病毒对公司临床开发、商业以及其他业务运营带来的影响,以及“近期业务亮点和预计里程碑事件”标题下的本公司的计划及预期的里程碑事件。由于各种重要因素的影响,实际结果可能与前瞻性声明有重大差异。这些因素包括了以下事项的风险:百济神州证明其候选药物功效和安全性的能力;候选药物的临床结果可能不支持进一步开发或上市审批;药政部门的行动可能会影响到临床试验的启动、时间表和进展以及产品上市审批;百济神州的上市产品及药物候选物(如能获批)获得商业成功的能力;百济神州对其技术和药物知识产权保护获得和维护的能力;百济神州依赖第三方进行药物开发、生产和其他服务的情况;百济神州有限的营运历史和获得进一步的营运资金以完成候选药物开发和商业化的能力;新冠病毒对公司临床开发、商业以及其他业务运营带来的影响;以及百济神州在最近季度报告的10-Q 表格中“风险因素”章节里更全面讨论的各类风险;以及百济神州向美国证券交易委员会期后呈报中关于潜在风险、不确定性以及其他重要因素的讨论。本新闻稿中的所有信息仅及于新闻稿发布之日,除非法律要求,百济神州并无责任更新该些信息。
[i] ABRAXANE®为 Abraxis 有限责任公司(属于百时美施贵宝公司)注册商标;瑞复美®和维达莎®为新基医药公司(属于百时美施贵宝公司)的注册商标。 [ii] 安加维®(XGEVA®)为安进公司的注册商标。消息来源:百济神州

